无机化学期末考试总结内容,自用。
气体溶液
气体
- 理想气体状态方程:\(pV=nRT,R=8.315\)(J或kPa/L)
- 道尔顿分压定律:\(p=\sum_i p_i\)
- 混合气体某组分气压:\(p_i=x_ip\) ## 溶液 拉乌尔定律:
- \(p=p_B·x_B\),在一定温度下,难挥发非电解质稀溶液的饱和蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数。
- \(\Delta p=p_B·x_A\),稀溶液的蒸气压降低值与溶质的摩尔分数成正比。
- \(\Delta p=p_B·b/55.6\),b为摩尔质量分数 稀溶液的依数性:
- \(\Delta p=K_p·b\)
- \(\Delta T_b=K_b·b\)
- \(\Delta T_f=K_f·b\)
 ## 胶体
## 胶体 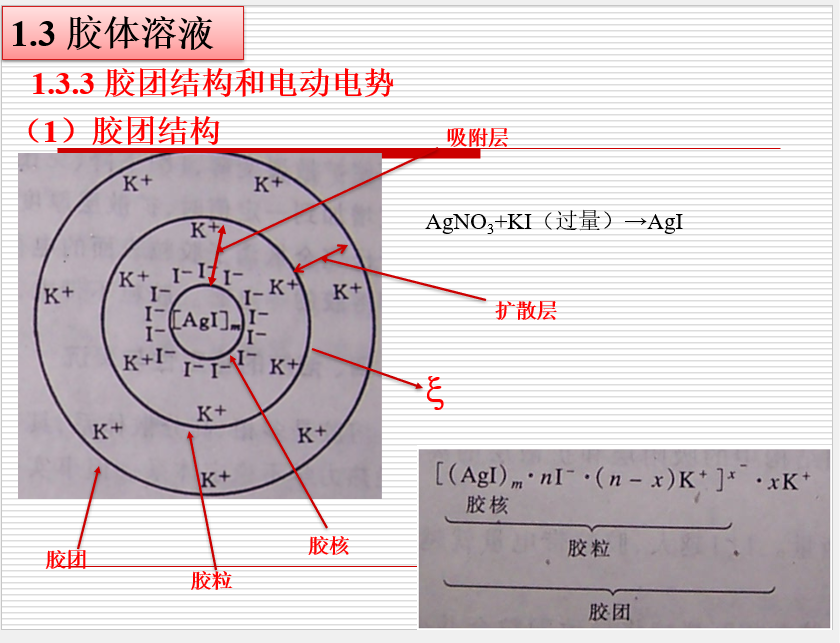
化学热力学初步
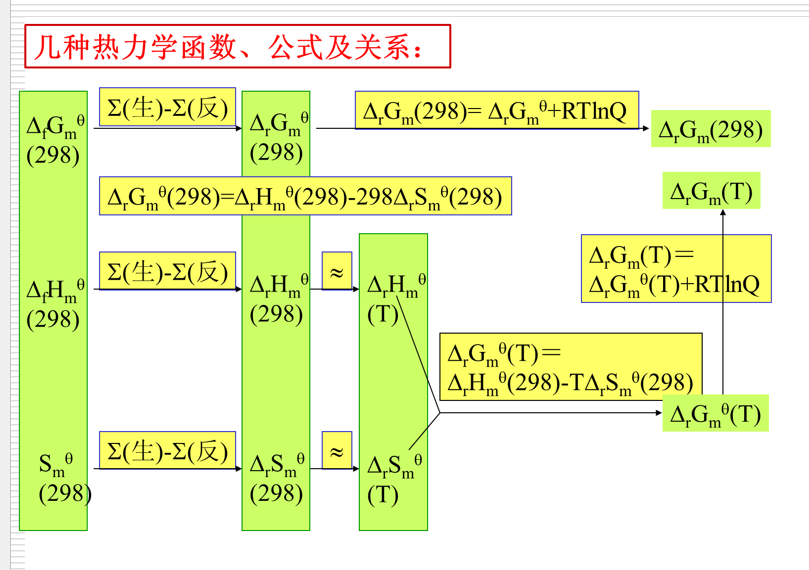 \(\Delta U=Q+W\),\(W=-p\Delta V\)
\(\Delta U=Q+W\),\(W=-p\Delta V\)
焓变的定义:\(H=U+pV=U+(\Delta n)RT\)  反应标准焓变:\[\Delta _rH^{\theta}_m=\sum v_B \Delta _fH^{\theta}_m(B)\]
反应标准焓变:\[\Delta _rH^{\theta}_m=\sum v_B \Delta _fH^{\theta}_m(B)\]
吉布斯自由能:\(G=H-TS\)
范托夫等温方程:\(\Delta _rG=\Delta _rG^{\theta}+RTlnQ\)
化学平衡


 ## 两个温度下K的关系 \[ln\frac{K_2^{\theta}}{K_1^{\theta}}=\frac{\Delta _rH^{\theta}}{R}\frac{T_2-T_1}{T_2T_1}\] ## 浓度对反应速率的影响
## 两个温度下K的关系 \[ln\frac{K_2^{\theta}}{K_1^{\theta}}=\frac{\Delta _rH^{\theta}}{R}\frac{T_2-T_1}{T_2T_1}\] ## 浓度对反应速率的影响 
 ## c与t的关系
## c与t的关系 

氧化还原反应
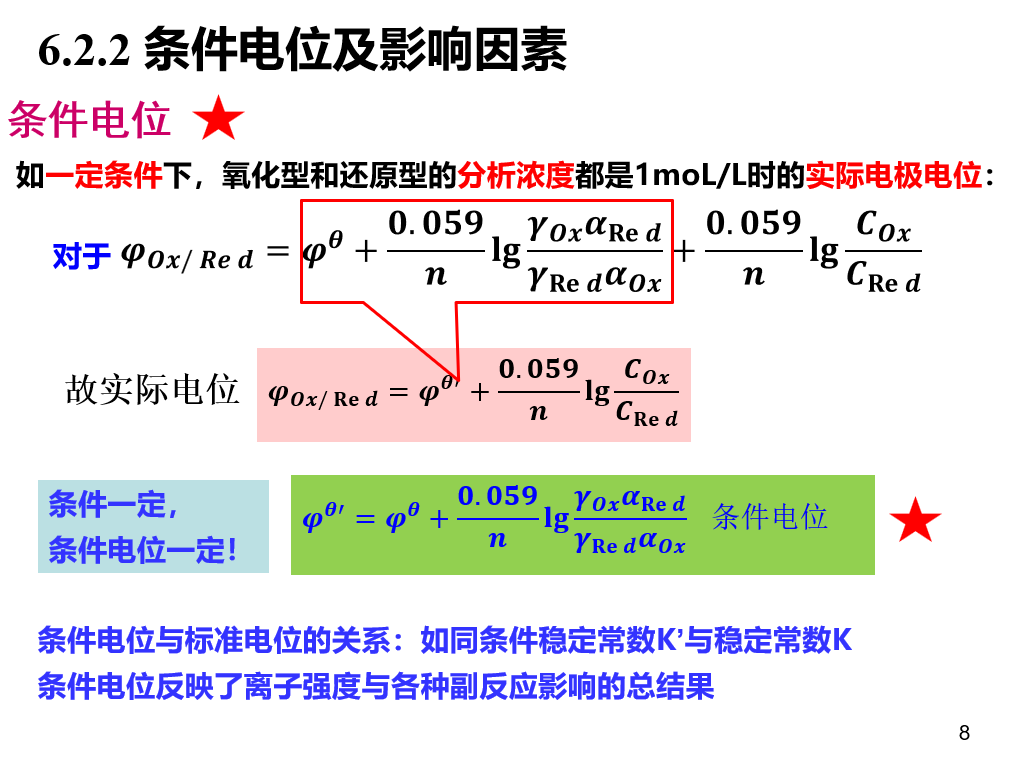
 能斯特方程:\[\phi=\phi^{\theta}-\frac{RT}{zF}ln\frac{a(还原)}{a(氧化)}\] 其中\(F=96485C·mol^{-1}\)
能斯特方程:\[\phi=\phi^{\theta}-\frac{RT}{zF}ln\frac{a(还原)}{a(氧化)}\] 其中\(F=96485C·mol^{-1}\)
当温度为298K时,有: \[\phi=\phi^{\theta}-\frac{0.0592V}{z}lg\frac{a(还原)}{a(氧化)}\]
原电池电动势与吉布斯自由能的关系: \[\Delta _rG=-zFE\] 标准状态下: \[\Delta _rG^{\theta}=-zFE^{\theta}\]  平衡常数与电动势的关系: \[lgK^{\theta}=\frac{zE^{\theta}}{0.0592}\]
平衡常数与电动势的关系: \[lgK^{\theta}=\frac{zE^{\theta}}{0.0592}\] 

原子结构

 # 分子结构 ## 离子键 - 离子键的本质:静电引力。离子键无饱和性和方向性。 - 同一周期正离子半径随离子电荷的增加而减小,负离子半径随电荷的增加而增大。 - 同一元素的原子半径大小:\(X^+<X<X^-\)正离子最小,负离子最大。 - 离子半径越小,离子间吸引力越大,相应化合物越稳定,熔沸点越高。 - 离子电荷高,对相反电荷的离子静电引力越强,则离子键越强,因而化合物的熔点也越高。 - 离子的电子构型对化合物的性质也有一定影响。NaCl、CuCl - 晶格能U——气体正离子和气态负离子结合1mol晶体释放的能量,U越大离子晶体越稳定。 ## 共价键 - 共价键具有饱和性和方向性 ## 杂化轨道理论 - 杂化轨道特性:能量相近才能杂化,成键能力大于未杂化,参与杂化的原子轨道数目与形成杂化轨道数目相等,取向不同。 - 杂化分为:sp杂化(sp3,sp2,sp)和spd杂化(sp3d,sp3d2)
# 分子结构 ## 离子键 - 离子键的本质:静电引力。离子键无饱和性和方向性。 - 同一周期正离子半径随离子电荷的增加而减小,负离子半径随电荷的增加而增大。 - 同一元素的原子半径大小:\(X^+<X<X^-\)正离子最小,负离子最大。 - 离子半径越小,离子间吸引力越大,相应化合物越稳定,熔沸点越高。 - 离子电荷高,对相反电荷的离子静电引力越强,则离子键越强,因而化合物的熔点也越高。 - 离子的电子构型对化合物的性质也有一定影响。NaCl、CuCl - 晶格能U——气体正离子和气态负离子结合1mol晶体释放的能量,U越大离子晶体越稳定。 ## 共价键 - 共价键具有饱和性和方向性 ## 杂化轨道理论 - 杂化轨道特性:能量相近才能杂化,成键能力大于未杂化,参与杂化的原子轨道数目与形成杂化轨道数目相等,取向不同。 - 杂化分为:sp杂化(sp3,sp2,sp)和spd杂化(sp3d,sp3d2)
| 杂化方式 | 杂化夹角 | 分子空间结构 | 示例 |
|---|---|---|---|
| \(sp\) | \(180^o\) | 直线 | \(CO_2\) |
| \(sp^2\) | \(120^o\) | 正三角形 | \(BCl_3\) |
| \(sp^3\) | \(109^o28^{'}\) | 正四面体 | \(CH_4\) |
| \(sp^3d\) | \(90^o,120^o\) | 三角双锥 | \(PCl_5\) |
| \(sp^3d^2\) | \(90^o\) | 正八面体 | \([Fe(CN)_6]^{3-}\) |
价层电子对互斥理论
\[价电子对数=(中心原子价电子数+配体B提供电子数-离子电荷数代数值)÷2\],结果四舍五入 \(氢元素和卤素原子各提供1个价电子;氧和硫原子提供的电子数为零;氮原子提供的电子数为-1\)  根据价电子数:2,3,4,5,6确定理想构型为:直线型、正三角形、正四面体、三角双锥、正八面体。
根据价电子数:2,3,4,5,6确定理想构型为:直线型、正三角形、正四面体、三角双锥、正八面体。
再根据配位原子个数推断形状,一个原子占据一对电子,剩下为孤对电子。 ## 分子的极性和分子间作用力 分子间作用力包括范德华力和氢键。 范德华力包括:定向力、诱导力、色散力。 - 定向力在极少数强极性的分子中才是最主要的分子间力,如H2O、HF中;一般是次要的作用力。 - 非极性分子在极性分子(可视为外电场)的作用下,可发生正、负电荷重心的相对位移,产生诱导偶极。 - 分子中电子和原子核的瞬间位移而产生瞬间偶极,瞬间偶极的作用只能产生于相邻分子间,这种相互吸引便是色散力。 - 任何分子间均有色散力,色散力是分子间的主要作用力。分子量越大,色散力越大。 - 分子间作用力的大小会影响物质的熔点、沸点、溶解度,表面吸附等 # 离子极化 离子和分子一样,在阴、阳离子自身电场作用下,产生诱导偶极,导致离子的极化。 # 氢键 - 分子间氢键的存在使相应共价化合物的熔、沸点变高。 - 分子内氢键未增大分子量,会使相应化合物分子熔沸点下降。 - 氢键具有方向性和饱和性。 # 晶体的内部结构 - 晶体具有各项异性。 - 原子晶体硬度大,熔点高。
酸碱滴定
分布系数
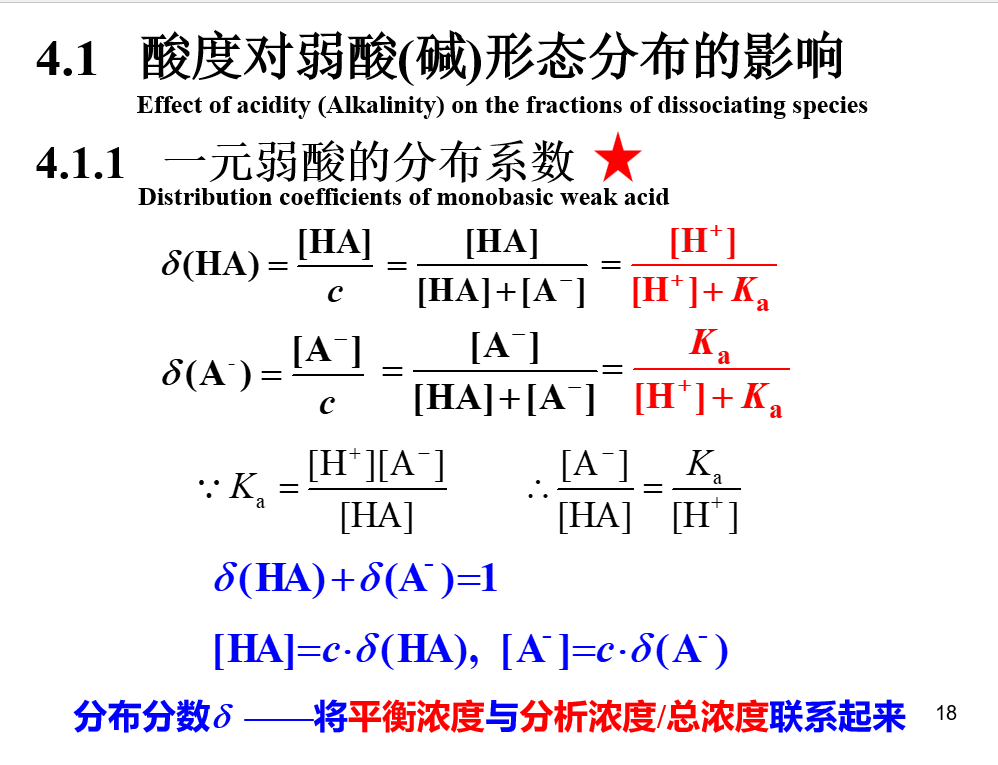
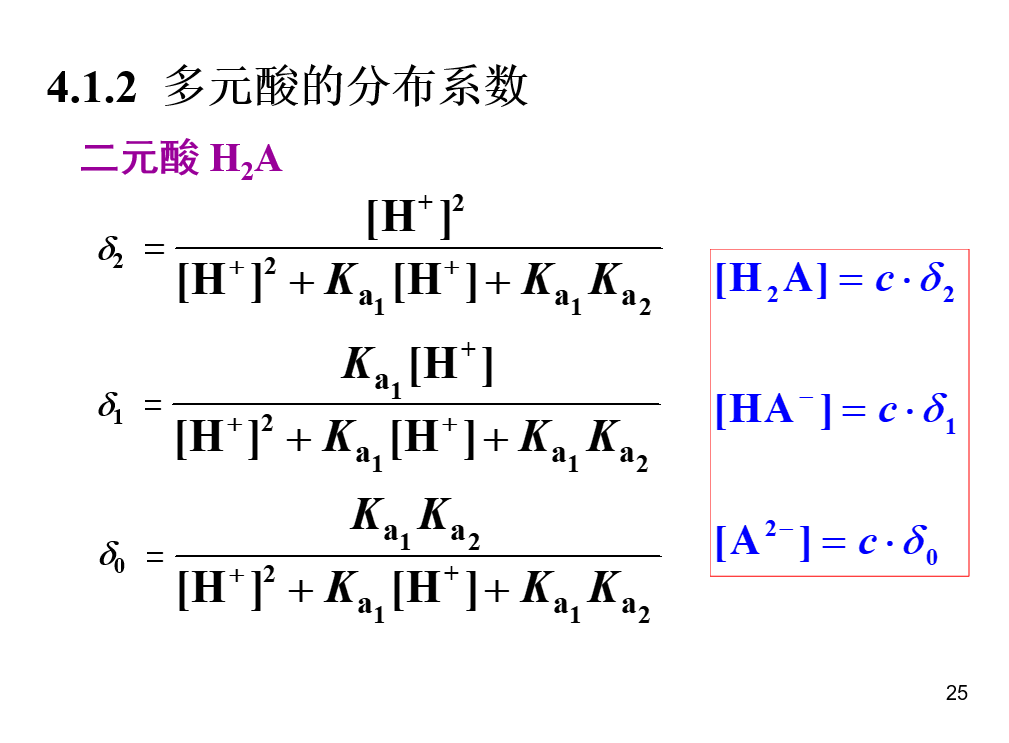
 ## 氢离子浓度的计算
## 氢离子浓度的计算 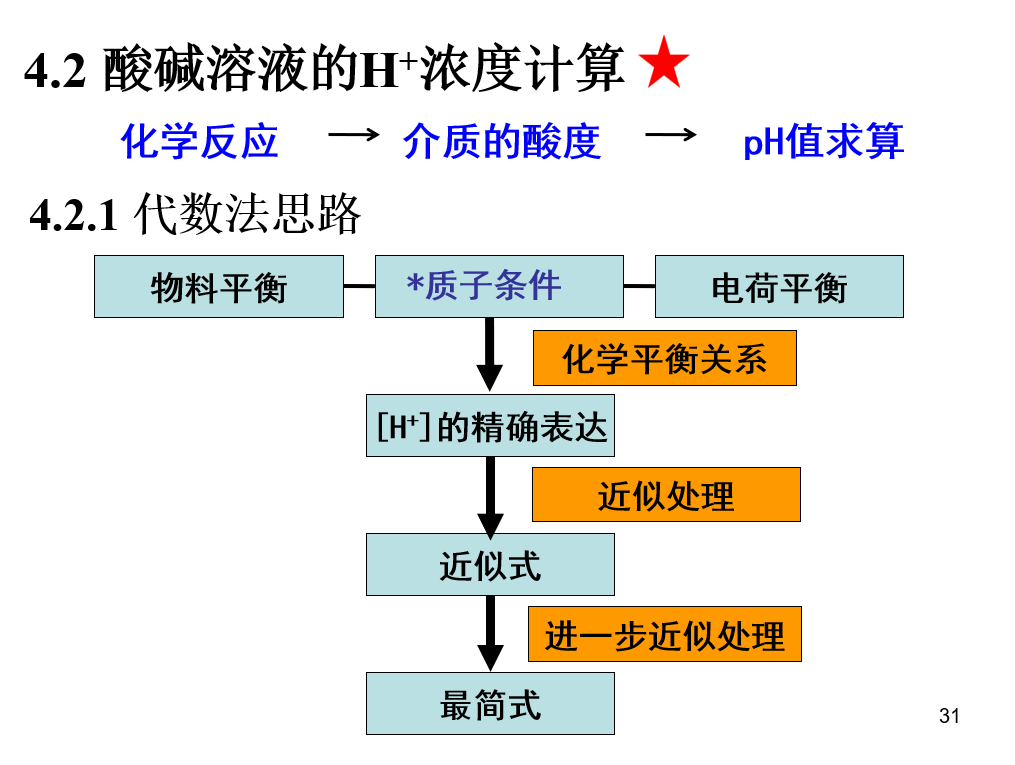
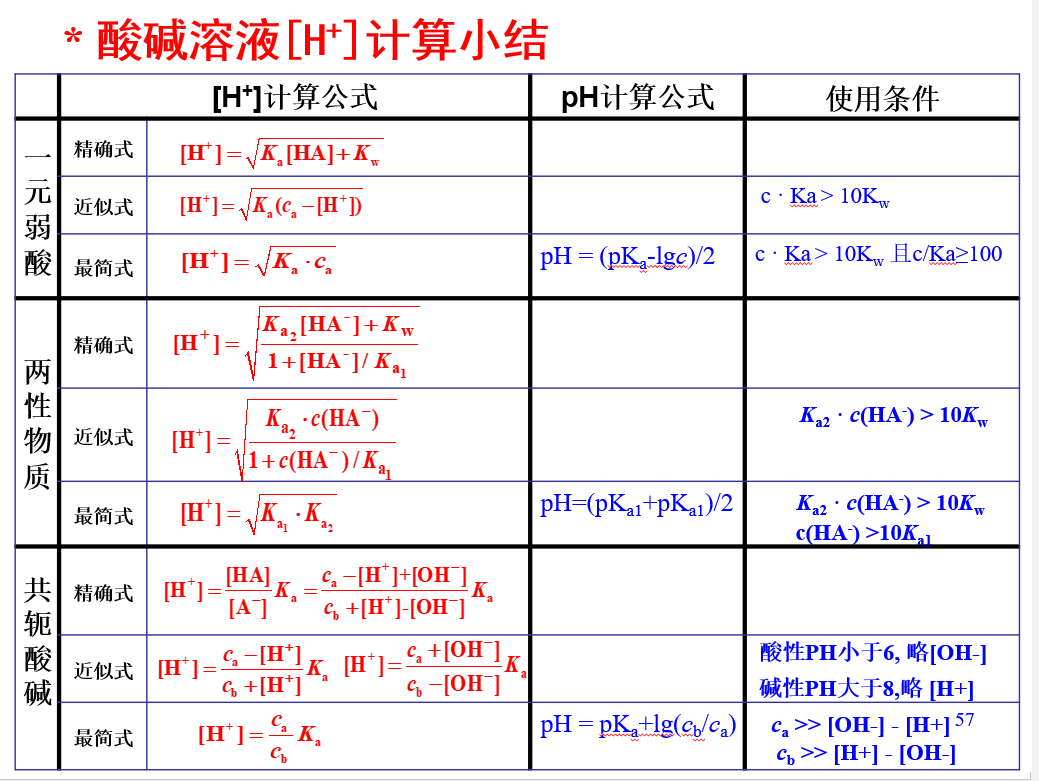 ## 缓冲溶液
## 缓冲溶液 
 \(pH=pK_a+lg\frac{c_b}{c_a}\),缓冲范围:\(pH=pK_a\pm 1\) ## 酸碱指示剂
\(pH=pK_a+lg\frac{c_b}{c_a}\),缓冲范围:\(pH=pK_a\pm 1\) ## 酸碱指示剂 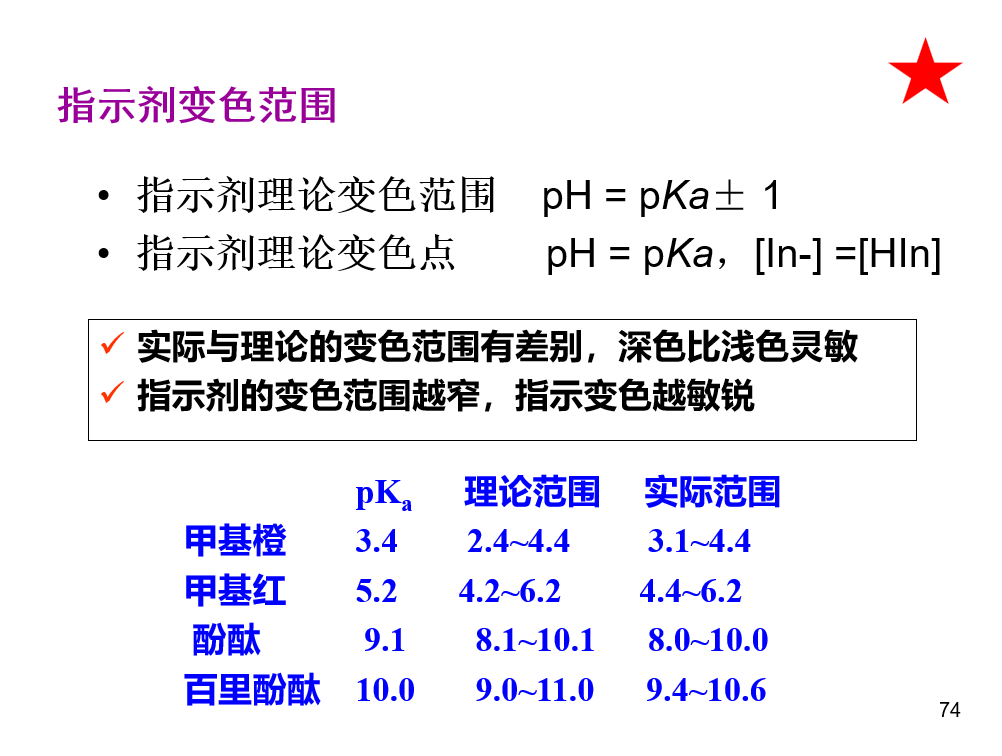 ## 酸碱滴定
## 酸碱滴定  突跃点sp:\([OH^-]=[H^+]=\sqrt{K_b*c(A^-)}\) # 配位滴定 ## 络合平衡
突跃点sp:\([OH^-]=[H^+]=\sqrt{K_b*c(A^-)}\) # 配位滴定 ## 络合平衡 
 重要公式: \[\beta _I=\frac{[ML_i]}{[M][L]^i}\] \[[ML_i]=\beta _i[M][L]^i\] ## 络合物的分布系数
重要公式: \[\beta _I=\frac{[ML_i]}{[M][L]^i}\] \[[ML_i]=\beta _i[M][L]^i\] ## 络合物的分布系数  ## 副反应系数
## 副反应系数 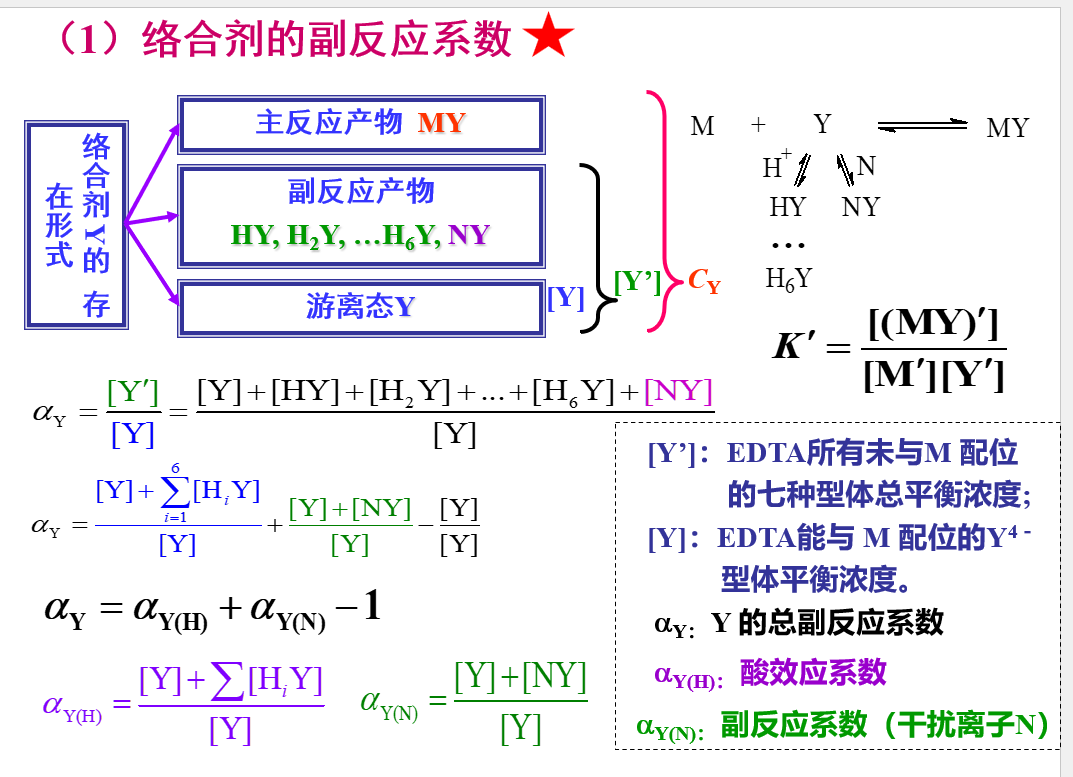
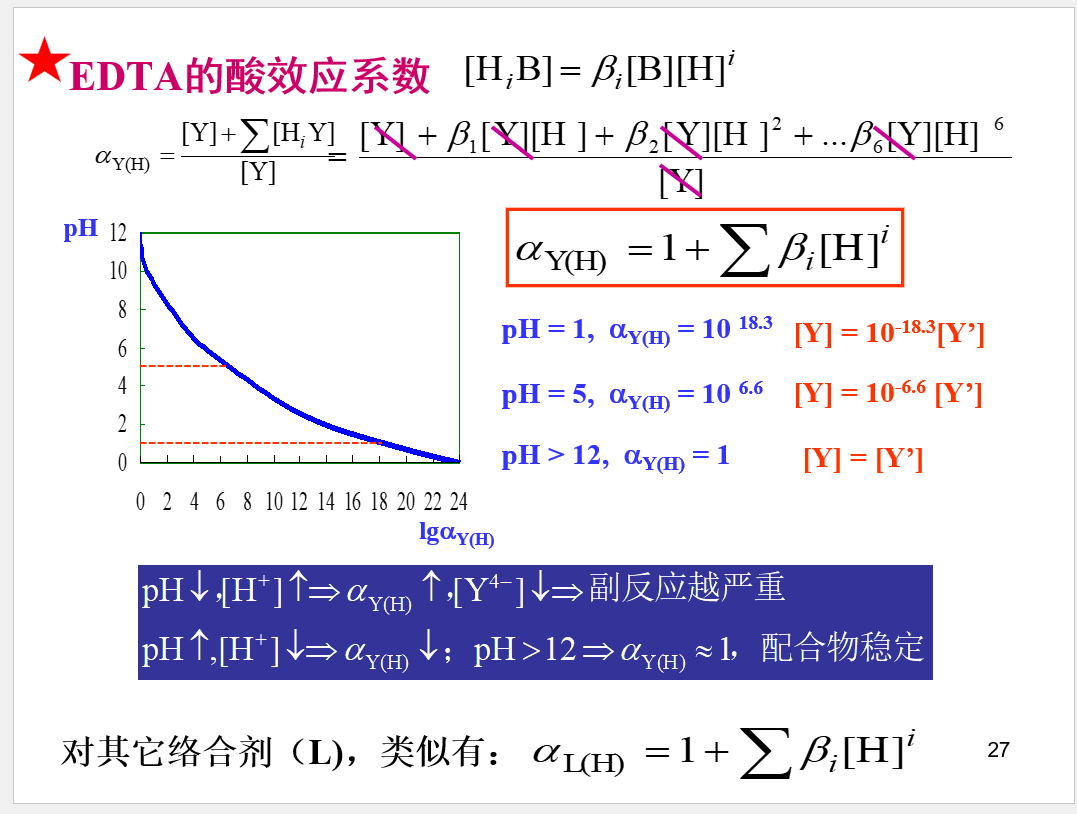
 ## 条件稳定常数
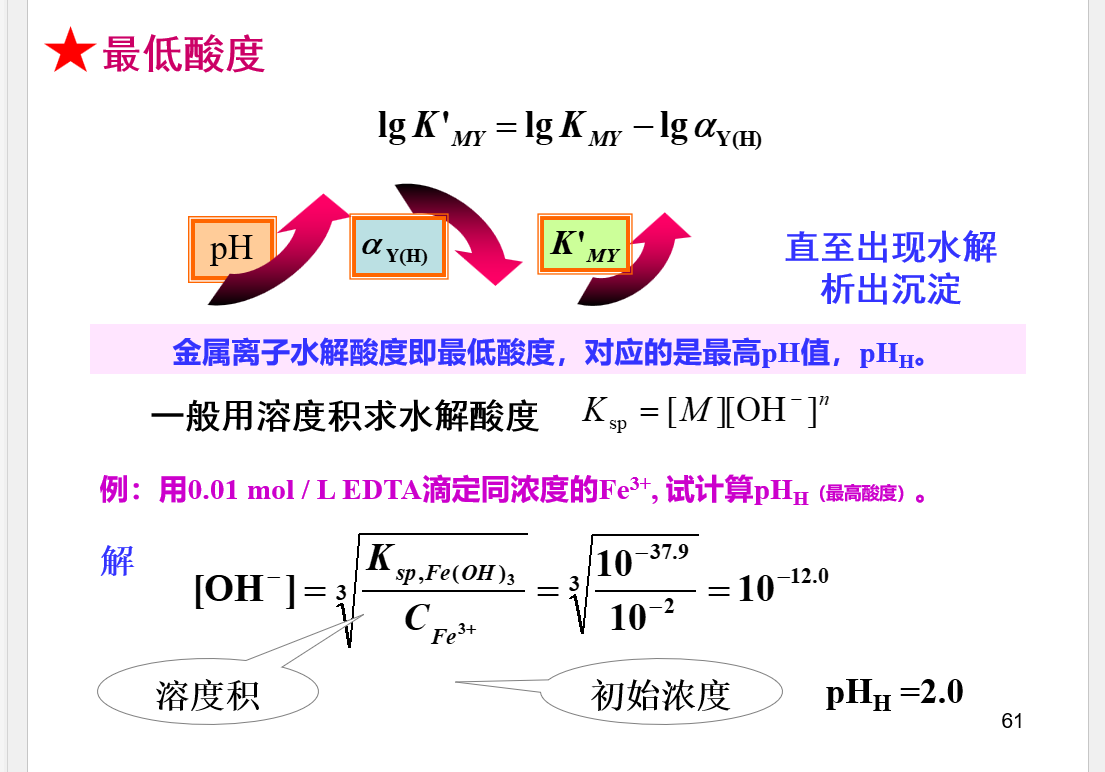
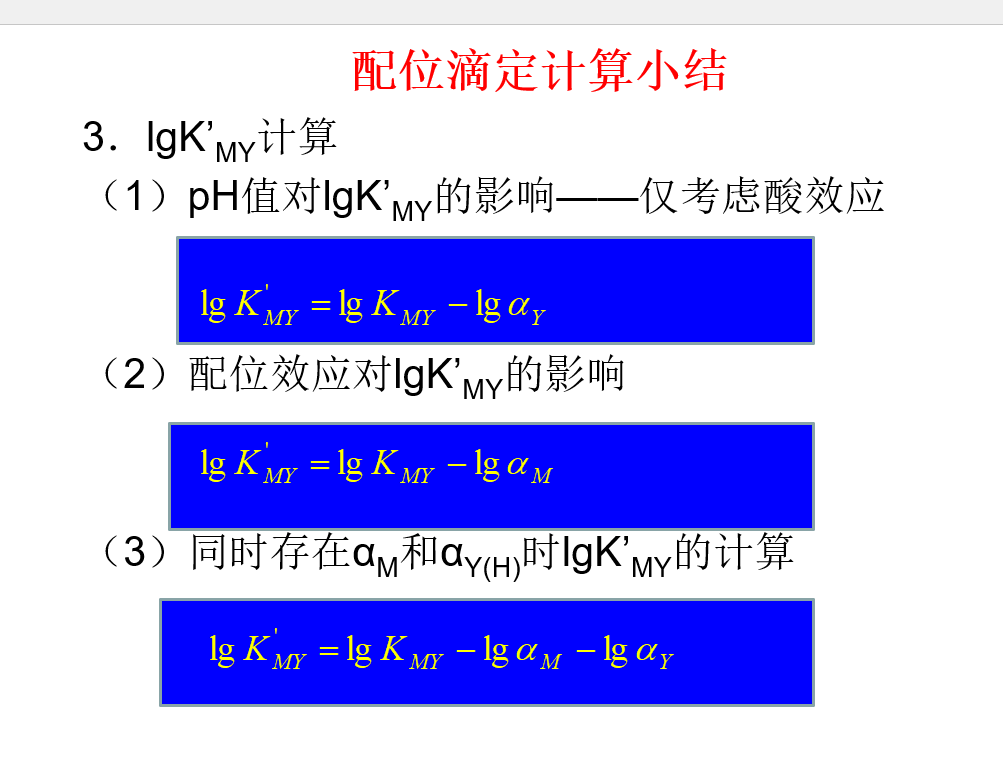
## 条件稳定常数 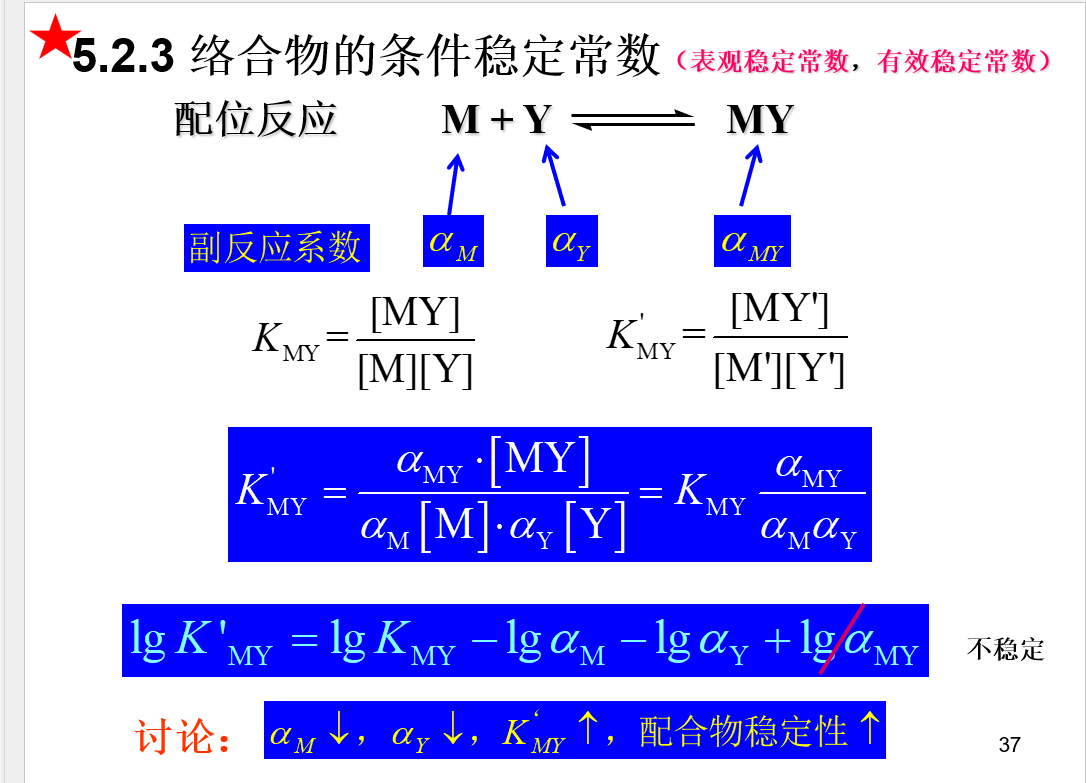 \[lgK^{'}_{MY}=lgK_{MY}-lg\alpha _{M}-lg\alpha _{Y}\] ## 络合滴定曲线
\[lgK^{'}_{MY}=lgK_{MY}-lg\alpha _{M}-lg\alpha _{Y}\] ## 络合滴定曲线 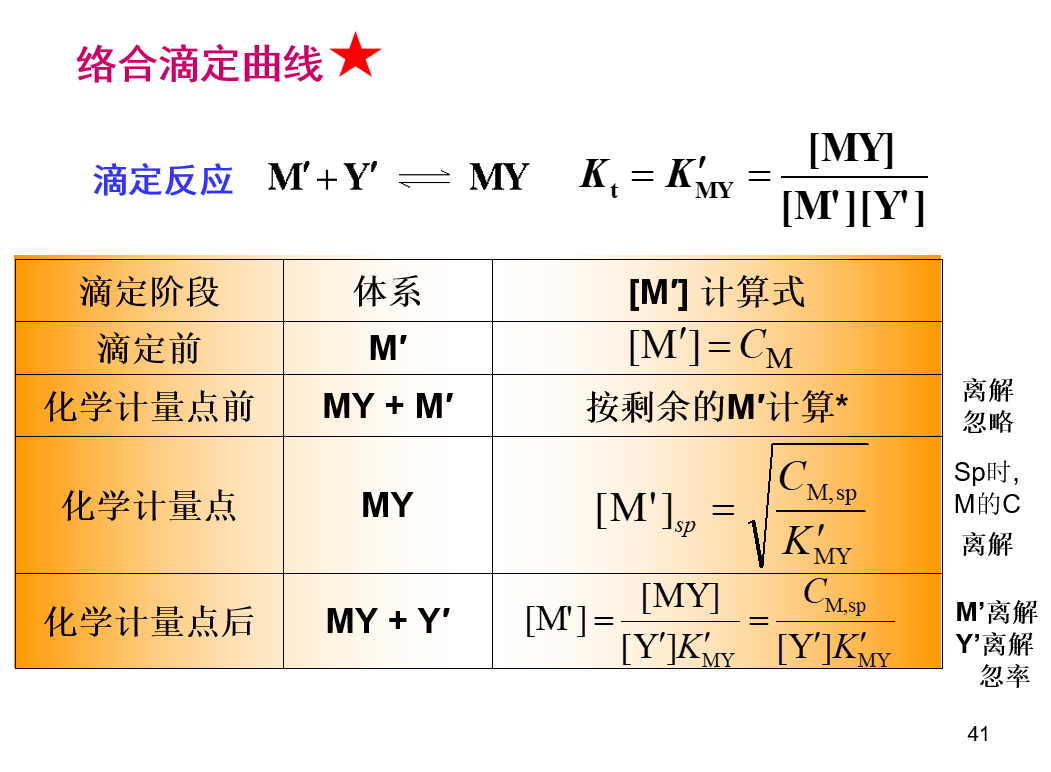 \[pM^{'}=\frac{1}{2}lgK_{MY}^{'}+\frac{1}{2}pC\] ## 酸度控制
\[pM^{'}=\frac{1}{2}lgK_{MY}^{'}+\frac{1}{2}pC\] ## 酸度控制 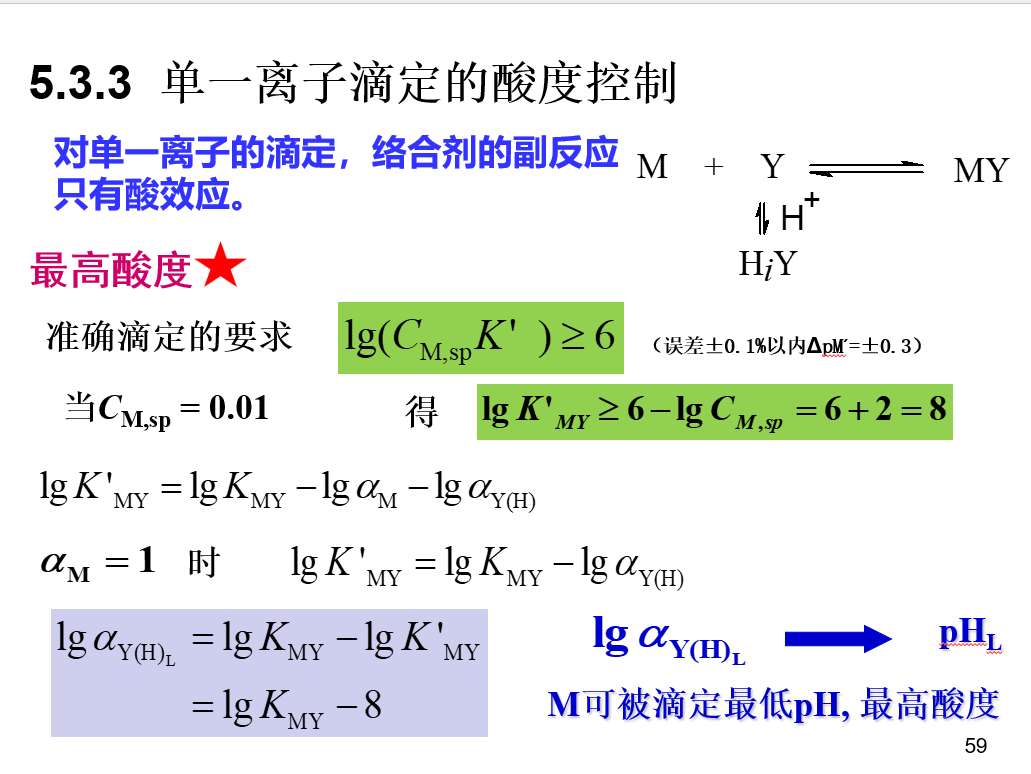
 ## 总结
## 总结 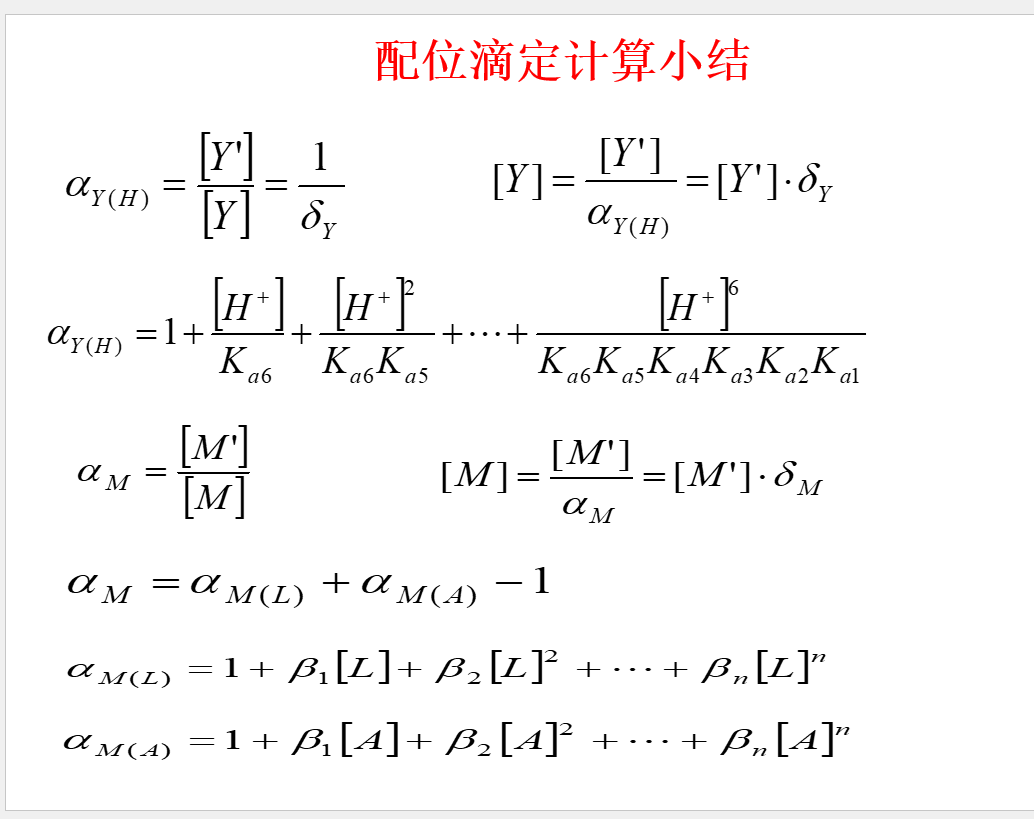


氧化还原滴定
条件电位
 ## 滴定曲线
## 滴定曲线 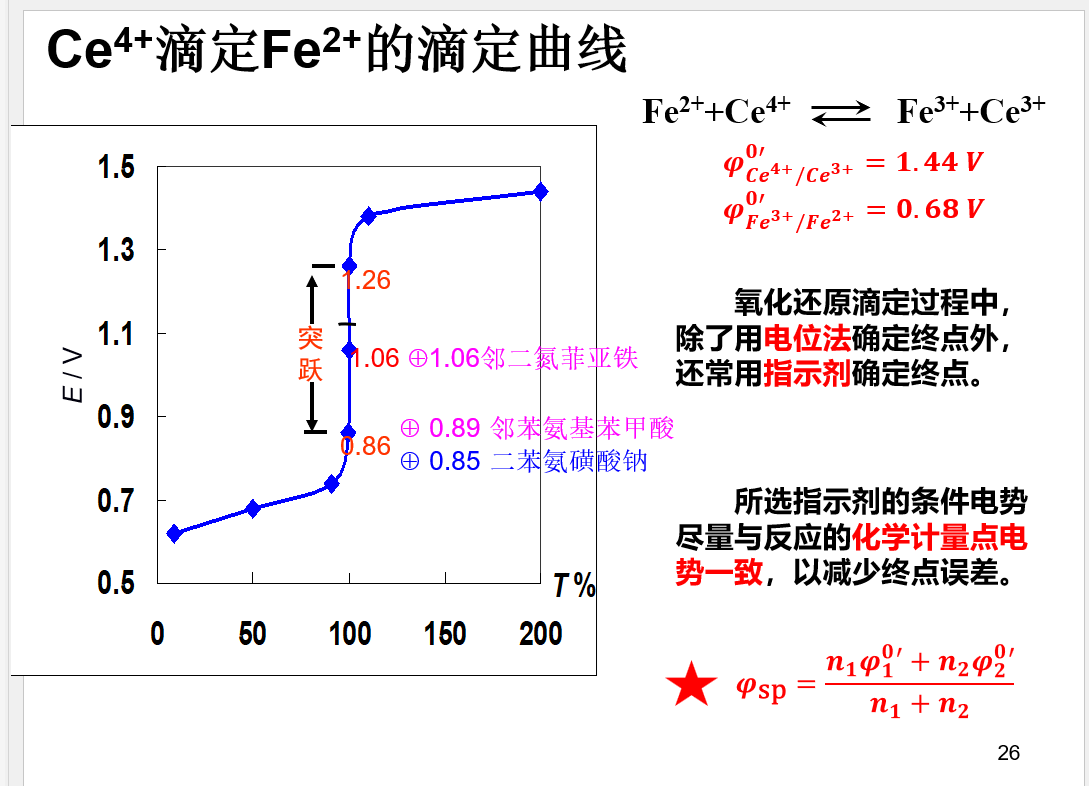
 ## 小结
## 小结 

沉淀滴定法
概念


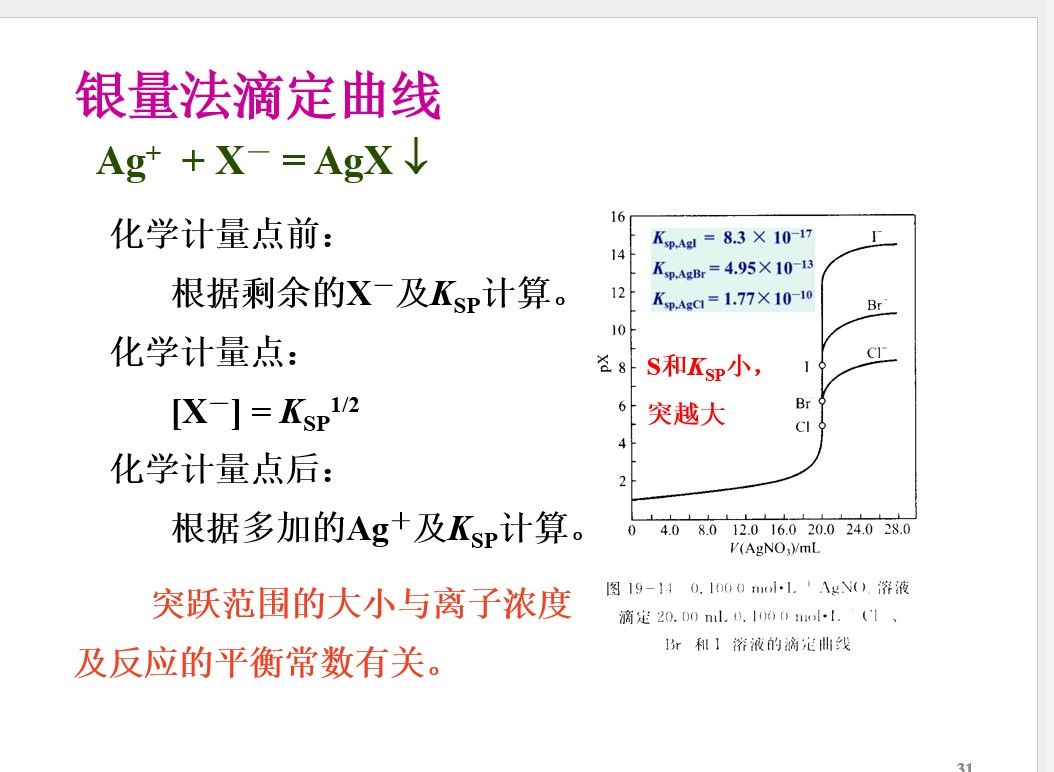 ## 滴定终点的确定
## 滴定终点的确定 


吸光光度法
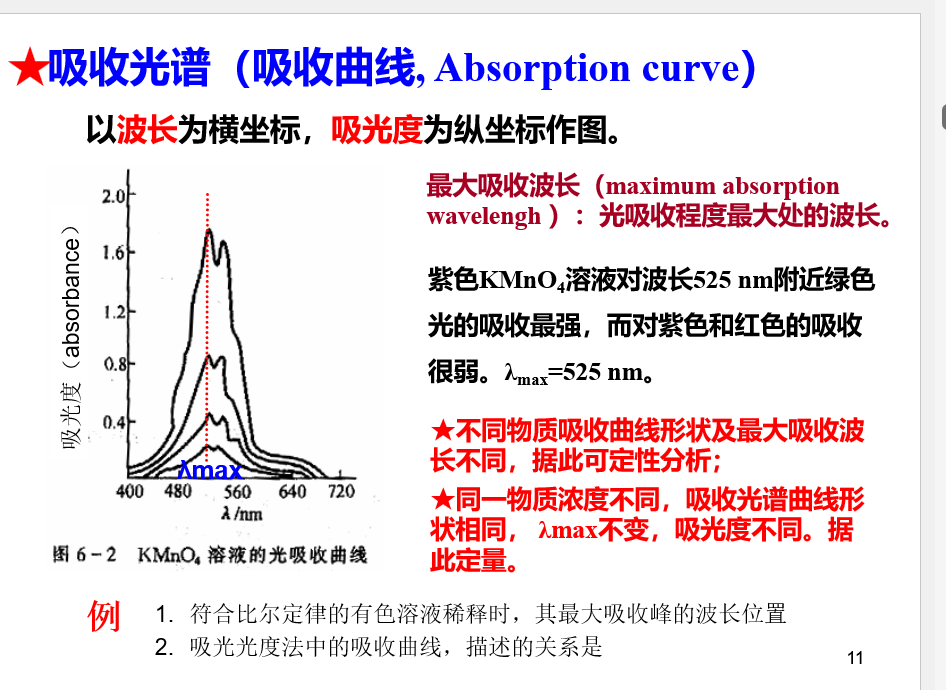 朗伯-比尔定律: \[A=lg\frac{I_0}{I_t}=lg\frac{1}{T}=Kbc\] 式中\(T=\frac{I_t}{I_0}\)为透射比,b为溶液厚度,c为溶液浓度,K为吸光常数。
朗伯-比尔定律: \[A=lg\frac{I_0}{I_t}=lg\frac{1}{T}=Kbc\] 式中\(T=\frac{I_t}{I_0}\)为透射比,b为溶液厚度,c为溶液浓度,K为吸光常数。


